Equilibrio ácido-básico: el concepto de PH.
La principal característica de los ácidos es que
contienen una gran proporción de iones de hidrógeno (H+) que tienen una carga
eléctrica positiva. Normalmente los átomos de hidrógeno tienen un protón en su
núcleo y un electrón que gira a su alrededor; como ocurre con todos los
elementos, el número de protones y de electrones suele ser igual. Cuando el
número de electrones es mayor o menor, el átomo se denomina ión.
Estos iones de hidrógeno son átomos
<<hambrientos>>, siempre en busca del electrón que les falta.
Cuando la proporción de estos H+ en un líquido determinado se hace
suficientemente alta, el líquido se convierte en un ácido y es corrosivo:
se <<come>> los electrones de otras sustancias.
Los álcalis o bases contienen una gran proporción
de iones hidróxilo (OH-). Al contrario del hambriento ión H+, el ión OH- lleva
un electrón <<extra>> y anda en busca de donarlo. Así pues, cuando
se encuentran un OH- y un H+ , se unen y se neutralizan mutuamente formando
agua (H2O) y una sal. Por ejemplo, de HC1 (ácido clorhídrico) + NaHCO3
(bicarbonato sódico) resulta-----> NaC1 (cloruro sódico=sal) + H2O (agua) + CO2
(dióxido de carbono).
Las cantidades de ácidos y bases contenidas en
los líquidos orgánicos han de mantenerse en un equilibrio constante. En
soluciones como las que se encuentran en el interior o en el exterior de las
células del organismo, los ácidos se disocian en iones de hidrógeno (H+) y
aniones. Por su parte, las bases se disocian en iones de hidróxido (OH-) y
cationes. Cuanto mayor sea el número de iones de hidrógeno presentes en una
solución, más ácida será ésta; por el contrario, cuanto mayor sea el número de
iones de hidróxido, más básica (alcalina) será esta solución.
Las reacciones bioquímicas (es decir, las que
tienen lugar en los sistemas vivos) son muy sensibles a los cambios, incluso
muy pequeños, de la acidez o alcalinidad. Toda separación de los estrechos
límites de las concentraciones normales del H+ y OH- puede inducir grandes modificaciones
de las funciones de las células y alterar la homeostasis. Por esta razón, los
ácidos y las bases que se están formando constantemente en el organismo han de
mantener un equilibrio.
La acidez o alcalinidad de una solución se
expresa en una escala de PH, que oscila entre 0 y 14. Para saber el grado de
acidez o alcalinidad de un líquido o tejido normalmente nos fijamos sólo en la
concentración de H+ presente. Esta cifra nos la da el famoso “PH”, que
significa “una parte de iones de hidrógeno por cada 10n. Y esto
significa lo siguiente:
En el agua destilada a 22ºC de temperatura hay 1
gramo de iones de hidrógeno (H+) y 1 gramo de iones de hidroxilo (OH-) por cada
10.000.000 de litros de agua. La proporción del agua es entonces de 1/107
o 1/10-7. El pH del agua es así 7; un pH 7 significa que la solución
contiene una diezmillonésima parte (0,0000001) de un mol de iones de hidrógeno
por litro. El número 0,0000001 se expresa como 10-7 en notación
científica (forma exponencial), que indica que el número es 1 con una coma
decimal desplazada 7 lugares hacia la izquierda. Para convertir este valor en
pH, el exponente negativo (-7) se cambia por el número positivo (7).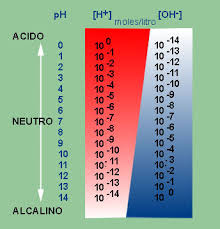
Los ácidos
tienen una mayor proporción de H+. Por ejemplo, la cerveza tiene un pH de 4,5
lo cual significa que hay 1 gr de H+ para 150.000 litros de líquido. El ácido
del estómago, que es muy corrosivo, tiene un pH de 1,1 es decir tiene 1 gr de
H+ para sólo 10 litros de líquido. Un cambio de un número entero en la escala
de PH representa un cambio de 10 veces en relación a la concentración previa.
Un pH 1 denota 10 veces más H+ que un pH 2. Un pH 3 indica 10 veces menos H+
que un pH 2 y 100 veces menos H+ que un pH 1.
Lo importante a recordar aquí es que cuando la
cifra baja, la acidez sube.
El punto medio de la escala es el 7, y en él las
concentraciones de H+ y de OH- son iguales. Una sustancia con un pH de 7, como
el agua pura destilada, es neutra porque tiene igual cantidad de H+ y de OH-. Un
pH inferior a 7 se considera ácido y contiene más H+ que OH-. Mientras que un pH
superior a 7 es alcalino ya que tiene mayor cantidad de OH- que de H+.
Mantenimiento del PH: sistemas tampón.
Aunque el pH de los líquidos orgánicos puede diferir, los límites normales de los distintos líquidos son habitualmente muy específicos y estrechos. El pH del plasma sanguíneo ha de mantenerse en una constante entre 7,35 y 7,45. La más ligera desviación en cualquier sentido significa problemas. Un pH ácido de 6,95 es causa de un coma diabético y muerte; un pH alcalino de 7,7 causa convulsiones tetánicas y finalmente la muerte. Un pH más ácido de la sangre hace más lento el ritmo cardíaco, mientras que un pH más alcalino lo acelera.
Los mecanismos homeostáticos mantiene el PH de la sangre entre 7,35 y 7,45, es decir un pH algo más básico (alcalino) que el del agua pura. El pH debe mantenerse en esta constante,incluso aunque continuamente se ingieran ácidos y bases fuertes o se formen éstos en el organismo, el pH de los líquidos del interior y del exterior de las células debe permanecer en este rango de pH.
El cuerpo tiene varios mecanismos para asegurar su equilibrio homeostático. Cuando el grado de acidez del torrente sanguíneo se eleva por el movimiento de los músculos y la oxidación de las proteínas y almidones, estos ácidos:
* Se descomponen en agua y dióxido de carbono, para ser eliminados a través de los riñones, la piel y los pulmones.
* Son utlizados por el estómago para la digestión en forma de ácido clorhídrico (¿se ha fijado cómo mejora la digestión un paseo después de comer?).
* Son neutralizados y excretados en forma de sales por los riñones.
* Son neutralizados por la presencia de los minerales que quedan del metabolismo de los alimentos alcalinizantes (efecto tampón).
Desde el punto de vista de la nutrición, los alimentos se clasifican en acidificantes y alcalinizantes, según los efectos que producen en el cuerpo, no según su grado intrínseco de acidez o alcalinidad. De esta manera, muchos alimentos de sabor "ácido" (las uvas y los cítricos, por ejemplo) se consideran alcalinizantes. porque al ser metabolizados dejan un residuo alcalinizante: sus ácidos orgánicos que afectan a las papilas gustativas son disueltos y convertidos en dióxido de carbono y agua, y los minerales que quedan sirven para neutralizar los ácidos corporales. De hecho, esto es cierto en muchas frutas y verduras, como también en las algas (dulse, kelp, hijiki, nori), que son alimentos ricos en minerales de efecto tampón (sodio, potasio, calcio, magnesio, hierro).
Por otro lado, los alimentos de sabor suave (la harina, el pescado y los cereales, por ejemplo, y por supuesto la carne) suelen ser acidificantes: al metabolizarse dejan como residuos ácidos sulfúrico, fosfórico y clorhídrico. El azúcar y otros concentrados endulzantes, cereales, harina, grasas y las proteínas animales, también crean un medio ácido al ser metabolizados.
En química, los álcalis o bases se conocen también como neutralizantes (tampones) de los ácidos; amortiguan los efectos corrosivos de los ácidos. Podemos decir entonces que los alimentos alcalinizantes van a neutralizar a los acidificantes. Existen además alimentos que se clasifican en una categoría "tampón" aparte, porque pueden producir ambos efectos: hacen menos ácidos los alimentos ácidos debido a su contenido mineral, y menos alcalinos los alcalinos debido a su contenido proteínico. Estos son los productos derivados de la leche de cabra: yogur natural, queso fresco tipo Burgos, kéfir.

No hay comentarios:
Publicar un comentario